Inicial » Artigos » Breve percurso das descobertas dos elementos químicos
Ano 5, n. 15, 2012
Autor: Fábio Merçon
Sobre o autor: Fábio Merçon é professor associado do Instituto de Química da Universidade do Estado do Rio de Janeiro (UERJ). Engenheiro químico e licenciado em química pela UERJ, mestre e doutor em Engenharia Química pela Universidade Federal do Rio de Janeiro (UFRJ), tem experiência nas áreas de ensino de química, química ambiental e processos com membranas.
Publicado em: 28/08/2013
Hoje todos sabem que a matéria é constituída de átomos, mas nem todos sabem que, desde a Grécia antiga, o conceito de átomo vem-se modificando. Em função do número de prótons presente em seu núcleo, cada átomo corresponde a um elemento químico distinto. Essa diversidade de elementos químicos e as combinações entre eles é que formam as diferentes substâncias conhecidas.
As primeiras descobertas
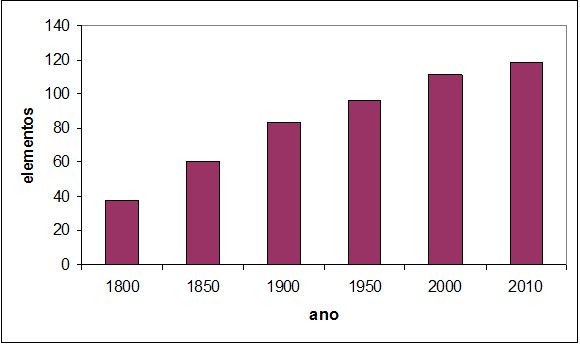
Alguns elementos químicos são conhecidos desde a Antiguidade, tais como o ferro, o chumbo, o ouro e o enxofre. Outros foram descobertos recentemente. O gráfico da figura 1 mostra uma correlação do número de elementos conhecidos em diferentes épocas. Como se pode observar, no início do século XIX, eram conhecidos menos de quarenta elementos químicos. A grande maioria dos elementos químicos foi descoberta nos séculos XIX e XX, e alguns poucos tiveram sua descoberta já no século XXI.
Antigas civilizações já conheciam e utilizavam as substâncias muitos séculos antes de haver uma definição científica de elemento químico. Existem registros históricos de uso de carbono, enxofre, ferro, chumbo, ouro, prata, estanho e mercúrio por romanos, gregos, egípcios e povos do oriente.
O desenvolvimento da Química como ciência experimental levou à identificação de muitos elementos a partir de pesquisas realizadas. Um exemplo são os estudos do cientista sueco Carl Wilhelm Scheele, responsável pelo isolamento e identificação de diversos elementos na década de 1770, tais como flúor, cloro, bário e molibdênio. Essas descobertas foram feitas com base em análises químicas de amostras de substâncias contendo esses elementos. O manganês e o nióbio, por exemplo, foram isolados a partir dos minerais pirolusita e columbita, respectivamente. Outros elementos foram obtidos a partir da separação dos gases atmosféricos, caso dos gases nobres, que são encontrados isolados na natureza.
A necessidade de padronização e organização dos elementos
A profusão de elementos químicos descobertos por cientistas de diversas nacionalidades necessitava de uma organização. No início do século XIX, o químico sueco Jöns Jacob Berzelius fez uma proposta que nos acompanha até os dias de hoje: empregar uma simbologia baseada nas iniciais dos nomes dos elementos traduzidos, geralmente, para o latim. Vejam-se os símbolos do enxofre e do chumbo, representados respectivamente por S e Pb, em função de seus nomes em latim: sulfur e plumbum. Essa padronização diz respeito apenas aos símbolos; os nomes dos elementos são escritos na língua de cada país. Assim, o símbolo Ag (do latim, argentum) representa o elemento denominado prata em português, silver em inglês, argento em italiano e ασήμι em grego.
Além da padronização da simbologia dos elementos químicos, houve uma busca por uma forma sistemática de organizá-los. Na década de 1860, ainda com um reduzido número de elementos químicos conhecidos, propostas de classificação ganharam destaques. Johann Wolfgang Döbereiner agrupou os elementos com propriedades semelhantes em grupos de três, que ficaram conhecidos como as tríades de Döbereiner. Alexandre-Émile Béguyer de Chancourtois organizou os elementos químicos em uma escala em espiral, conhecida como parafuso telúrico de Chancourtois. John Alexander Reina Newlands organizou os elementos em séries de oito, conhecidas como a lei das oitavas de Newlands.
Por fim, Dimitri Ivanovich Mendeleev e Julius Lothar Meyer propuseram classificações semelhantes e que viriam a ser a base da classificação moderna. Mendeleev desenvolveu um trabalho mais meticuloso, alcançando maior destaque. Seu trabalhou foi tão cuidadoso, que ele deixou espaços vazios em sua classificação a serem preenchidos por elementos químicos que ainda não haviam sido descobertos. A figura 2 apresenta a proposta original de classificação feita por Mendeleev.

Esses estudos foram a base para o desenvolvimento da atual tabela de classificação periódica dos elementos, feita por Henry Gwinh Albericosdete-Jeffreys Moseley no início do século XX, encontrada nos livros didáticos e nas provas de concursos de vestibulares.
Os elementos químicos artificiais
A classificação periódica dos elementos químicos é um documento em constante mudança. Essas mudanças decorrem principalmente da produção em laboratório de novos elementos químicos.
Noventa elementos químicos foram isolados na natureza. Entretanto, com o domínio das reações nucleares e dos aceleradores de partículas, os cientistas passaram a sintetizar novos elementos químicos. O princípio dessa síntese está fundamentado na colisão de átomos, que leva à formação de átomos com núcleos maiores. O elemento natural de maior número atômico é o urânio – seu número atômico é 92. Isso significa que o núcleo do átomo de urânio contém 92 prótons. Por meio de reações nucleares, foi possível a formação de átomos com mais de 92 prótons, denominados transurânicos. Esses átomos constituem elementos químicos artificiais.
Além dos elementos transurânicos, existem dois elementos químicos artificiais com número atômico inferior a 92, tecnécio e promécio, denominados cisurânicos. O tecnécio foi o primeiro elemento químico produzido artificialmente; por isso, seu nome deriva do termo grego techneto, que significa “artificial”.
Na descoberta de elementos transurânicos, destacou-se o cientista norte-americano Glenn Theodore Seaborg. Em conjunto com seus colaboradores, em Berkley, na Universidade da Califórnia, Seaborg participou da síntese de nove novos elementos químicos. A produção desses elementos químicos tornou-se tão “corriqueira”, que os elementos amerício e cúrio foram anunciados por Seaborg em um programa de rádio, quando um menino de doze anos lhe perguntou sobre novas descobertas.
Na segunda metade do século XX, em plena Guerra Fria, Estados Unidos e a antiga União Soviética investiam esforços na busca da supremacia mundial. Nessa competição, o desenvolvimento tecnológico era uma demonstração de prestígio e poder, o que levava grupos distintos de pesquisadores a reivindicar a criação de um determinado elemento químico. Um exemplo da disputa é o elemento de número atômico 104, chamado de kurchatovium, pelos cientistas soviéticos do centro de pesquisa de Dubna, e de ruterfórdio, pelos cientistas norte-americanos da Universidade da Califórnia. Coube à União Internacional de Química Pura e Aplicada – IUPAC o reconhecimento da descoberta com o nome proposto pelos norte-americanos.
Os elementos químicos artificiais apresentam núcleos instáveis, que se desintegram com o tempo, formando átomos estáveis de menor número atômico. Em função dessa instabilidade, o tempo de existência desses elementos é variável. Uma forma de medir a estabilidade de um átomo é pela determinação de seu tempo de meia-vida, que corresponde ao tempo que metade de uma amostra leva para se desintegrar. Alguns átomos de elementos químicos artificiais possuem existência bastante longa depois de formados, em torno de bilhões ou milhões de anos, como o plutônio e o tório. Porém, existem átomos tão instáveis, que seus tempos de meia-vida equivalem a cerca de dez segundos, como o roentgênio e o copernício.
As descobertas em andamento
O reduzido tempo de meia-vida de alguns átomos dificultou sua identificação e, consequentemente, a comprovação de sua existência. Assim, resultados de experimentos de obtenção de novos elementos químicos divulgados por determinados centros de pesquisa costumam ser questionados pela comunidade científica. Visando a contornar controvérsias, a IUPAC estabeleceu que novos elementos químicos só serão “batizados” após terem sido oficialmente reconhecidos por essa entidade. Diante desses fatos, apenas em 2011 a IUPAC reconheceu e denominou os elementos de número atômico 114 e 116* como flerovium e livermorium, respectivamente.
A busca por novos elementos químicos continua. Um exemplo disso são os diversos estudos que indicam a produção dos elementos de número atômico 113, 115 e 118. Entretanto, ainda não há evidências conclusivas de suas descobertas. Esses elementos estão provisioriamente representados por uma combinação de letras associadas aos dígitos de suas massas atômicas: Uut, Uup e Uuo. Com o constante avanço da ciência e da tecnologia, a complementação da tabela periódica continua sendo foco de novos estudos.
NOTA:
* IUPAC. News: discovery of the elements with atomic number 114 and 116. Disponível em: http://www.iupac.org/web/nt/2011-06-01_elements_114_116. Acesso em: julho de 2011.