Inicial » Artigos » A radioatividade e a origem do não determinismo na ciência
Ano 7, n. 20, 2014
Autor: Vitor Oguri
Sobre o autor: Vitor Oguri é físico experimental de Altas Energias. Mestre em Física Aplicada pela Universidade de Tóquio e doutor em Física pelo Centro Brasileiro de Pesquisas Físicas (CBPF), é professor titular e pesquisador do Instituto de Física da Universidade do Estado do Rio de Janeiro (IF-UERJ), além de autor e organizador de diversos livros na área.
Publicado em: 05/08/2014
O estudo do fenômeno da radioatividade contribuiu para alargar a concepção acerca não só da estrutura da matéria como também para estabelecer uma visão não determinística dos fenômenos naturais. Este artigo se propõe a abordar esses dois tópicos importantes do desenvolvimento científico.
O fenômeno da radioatividade
O que chamamos radioatividade consiste na capacidade de certas substâncias, denominadas radioativas, de ionizar os átomos ou as moléculas da matéria. Esse fenômeno, descoberto pelo francês Henri Becquerel, em 1896, é também denominado decaimento radioativo. Logo após os trabalhos de Becquerel, o físico neozelandês Ernest Rutherford estabeleceu as principais características físicas do fenômeno da radioatividade. Primeiro, reconheceu duas espécies de radiações que emanavam das amostras radioativas, denominadas provisoriamente alfa (α) e beta (β). As principais diferenças entre elas estavam relacionadas ao poder de penetração na matéria. Enquanto os raios alfa podiam ser interceptados por uma simples folha de papel, os raios beta eram capazes de atravessar finas folhas metálicas.
Mais tarde, o francês Paul Villard descobriu uma terceira componente, denominada por Rutherford de raios gama (γ), com poder de penetração muito maior que os raios alfa e beta, ou mesmo que os raios X, como ilustra a figura 1.
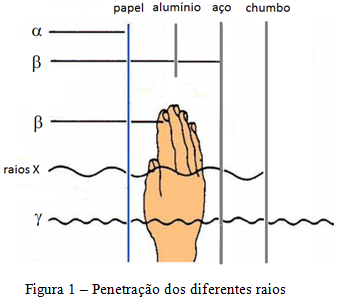
Em seguida, a polonesa Marie Curie mostra que os três tipos de radiação podiam ser identificados pela aplicação de um campo magnético perpendicular à direção de propagação inicial dos raios, como ilustrado na figura 2.
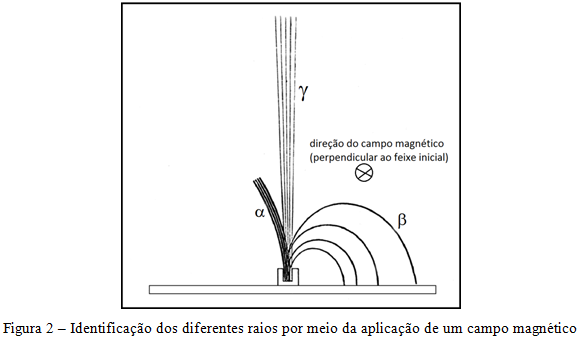
Em 1899, Becquerel determina que a razão entre a carga elétrica e a massa dos raios beta era praticamente igual à massa dos elétrons, o que permitiu identificar os raios beta como elétrons, sendo que os raios beta apresentavam energias maiores do que aquelas normalmente obtidas nos tubos de raios catódicos.
Os raios alfa, por sua vez, foram identificados por Rutherford como íons de átomos de hélio, em função de medições semelhantes da razão carga/massa dos raios betas e após introduzir o conceito de número atômico. Já os raios gama foram identificados como ondas eletromagnéticas, mas com energias mais altas que os raios X.
Rutherford, em 1906, descobre a chamada lei de decaimento, a qual estabelece que a atividade, isto é, o número de decaimentos ou desintegrações por segundo de uma amostra radioativa decai exponencialmente segundo e-t/τ, sendo τ (tau) um parâmetro característico da substância que compõe a amostra, denominado vida-média.
A lei de decaimento indica, portanto, que o número de átomos radioativos de uma amostra de um dado elemento químico após um instante t é proporcional ao fator exponencial e-t/τ, e a vida-média é o tempo médio que um átomo instável leva para decair ou se desintegrar totalmente, momento em que a atividade da amostra torna-se nula. A vida-média das diversas substâncias radioativas varia de microssegundos, minutos, dias, anos até bilhões de anos.
Após estabelecer a lei do decaimento, a partir de experimentos nos quais folhas de ouro eram bombardeadas por raios alfa, Rutherford infere que os átomos de qualquer elemento poderiam ser vistos como uma espécie de pequeno Sistema Solar, constituído por uma nuvem de elétrons em torno de um núcleo muito mais pesado, em uma região do espaço da ordem de10-5 vezes menor que o diâmetro dos átomos. Desse modo, Rutherford estabelece tanto a estrutura do átomo, descobrindo o núcleo atômico, como o fato de que o fenômeno da radioatividade se deve a processos que ocorrem nos núcleos dos átomos das substâncias radioativas. Note-se que os elétrons que constituem a nuvem em torno dos núcleos dos átomos não participam do processo de decaimento.
Ainda segundo Rutherford, uma grande quantidade de energia seria necessária para a formação de um núcleo, ou liberada durante a sua desintegração, quando comparada com as energias responsáveis pela estabilidade de um átomo. Esses achados deram início à área de estudo da Física Nuclear e da Física de Partículas.
Assim, os raios alfa são núcleos de hélio, os raios beta são elétrons, e os raios gama são pulsos eletromagnéticos. Mas o que leva os núcleos dos átomos a emitirem tais raios? Existem elétrons no interior dos núcleos?
O determinismo na ciência
Os trabalhos posteriores do grupo liderado por Rutherford, no laboratório Cavendish da Universidade de Cambridge, na Inglaterra, constituíram-se em um dos principais sinais de declínio da Mecânica Clássica de Newton, a teoria que se acreditava pudesse fundamentar o comportamento de todos os fenômenos naturais.
Ofereço [os Principia] como os princípios matemáticos da filosofia, pois toda a essência da filosofia parece consistir nisso – a partir dos fenômenos de movimento, investigar as forças da natureza e, então, a partir dessas forças, demonstrar os outros fenômenos. (Isaac Newton, em Princípios matemáticos de filosofia natural)
Com a expressão “em declínio”, considera-se apenas que a Mecânica Clássica não é mais a teoria fundamental da Física, mas continua sendo a teoria mais utilizada pelo homem na descrição de grande parte dos fenômenos que afetam a nossa vida, como o movimento dos planetas ou a maioria dos artefatos tecnológicos criados pelas engenharias. As novas teorias apenas revelaram os limites de aplicabilidade da Mecânica Clássica.
Cerca de duzentos anos após o sucesso na explicação do movimento dos planetas no Sistema Solar, a Mecânica Clássica havia alcançado o seu apogeu ao ser utilizada como fundamento para a concepção atomística da matéria, com a elaboração da Teoria Cinética dos Gases. A Teoria Cinética concilia a hipótese de que as leis fundamentais que regem o comportamento individual das partículas constituintes de um gás, as moléculas, seriam representadas por relações de causa e efeito, ou seja, cada molécula teria um comportamento completamente determinístico. Nas palavras do filósofo e matemático francês Pierre-Simon Laplace, em Essai philosofique sur les probabilités [Ensaio filosófico sobre as probabilidades]:
Devemos considerar o estado presente do Universo como o efeito de seu estado anterior e como a causa do que vai se seguir. Uma inteligência que, em um dado instante, conhecesse todas as forças que animam a natureza e a situação respectiva dos seres que a compõem e, além disso, fosse suficientemente ampla para submeter todos esses dados à análise compreenderia na mesma fórmula os movimentos dos maiores corpos do Universo e aqueles do mais leve átomo; nada lhe seria incerto, e o futuro bem como o passado estariam presente em seus olhos.
No entanto, por não ser possível na prática caracterizar o movimento individual de um número muito grande de partículas, tal como uma concentração da ordem de 1019 cm-3 nos gases, o comportamento coletivo dessas partículas apresenta uma regularidade estatística que decorreria de distribuições de probabilidades associadas às grandezas dinâmicas, como a energia ou a velocidade das moléculas de um gás.
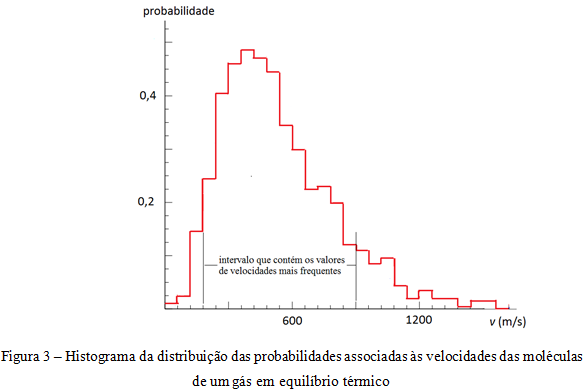
De acordo com distribuição apresentada no histograma da figura 3, as velocidades das moléculas estão distribuídas em uma ampla faixa de valores e, apesar de a maioria se deslocar com velocidades entre 200 m/s e 900 m/s, a média das velocidades é cerca de 500 m/s.
Na visão da ciência, a descrição probabilística devia-se a uma impossibilidade de natureza prática, atribuída apenas a nossa incapacidade de controlar ou apreender o movimento de um grande número de partículas. As previsões e conclusões sobre o comportamento dos sistemas macroscópicos, mesmo de natureza discreta, constituíram-se no grande triunfo da Mecânica Clássica de Newton, reforçando assim a hipótese atomística da matéria e a visão determinística do comportamento das partículas fundamentais da matéria, ou seja, dos processos fundamentais da natureza.
Rutherford, ao estabelecer a forma da lei de decaimento, mostrou também que o fenômeno se apresentava como aleatório, pois não se podia prever quando e qual núcleo decairia. No entanto, acreditava que a aleatoriedade, ou o acaso, resultava do comportamento estatístico de um grande número de núcleos que participavam do processo. Ou seja, Rutherford, bem como praticamente toda a comunidade científica da época, supunha que, apesar de cada núcleo individual obedecer a uma lei estritamente causal, o coletivo exibiria um comportamento estatístico, como no caso dos gases envolvidos nos fenômenos térmicos.
No entanto, se todos os átomos de uma amostra de um elemento químico são rigorosamente idênticos, como se pensava até o final do século XIX, como alguns átomos de uma mesma amostra poderiam decair em certo intervalo de tempo e outros não?
Nesse sentido, poder-se-ia antecipar que o acaso, ou a aleatoriedade do processo decaimento radioativo, não era de origem estatística, devido ao grande número de núcleos envolvidos, mas sim devido ao comportamento não determinístico de cada núcleo. Apesar dessas suposições feitas por alguns pesquisadores, como o francês Andrè Debierne em 1912, até o fim do primeiro quarto do século XX, não se obteve uma nova teoria física que embasasse a hipótese de que o comportamento de um único núcleo fosse aleatório.
O não determinismo na ciência
Assim, a compreensão satisfatória do fenômeno da radioatividade teve de esperar não só o descobrimento do nêutron, pelo inglês do grupo de Rutherford, James Chadwick, em 1932 (quando foi possível estabelecer os conceitos de isótopos e de elemento químico), como também a criação da teoria da Mecânica Quântica, pelo trabalho coletivo de físicos teóricos de várias nacionalidades, como os alemães Werner Heisenberg e Max Born, o suíço Wolfang Pauli, o austríaco Schrödinger e o inglês Paul Dirac, entre 1924 e 1925. A partir de então, segundo a Mecânica Quântica, a aleatoriedade passa a ser uma característica intrínseca da evolução dos fenômenos naturais. Para cada problema, mesmo em nível microscópico, como o comportamento de um único átomo ou de um núcleo, o que a teoria pode estabelecer são distribuições de probabilidade associadas às diversas grandezas físicas que descrevem um dado fenômeno.
A incerteza é inevitável no cálculo de resultados observacionais. Em geral, a teoria nos permite calcular somente a probabilidade de obtermos um resultado particular. (Paul Adrien Maurice Dirac, em The principles of Quantum Mechanics [Os princípios da mecânica quântica])
Outra característica do estudo dos fenômenos nucleares foi o grande intervalo de tempo entre a descoberta da lei do decaimento, aparentemente uma relação causal, o entendimento físico do fenômeno e a elaboração de uma teoria física probabilística, a partir da qual os processos nucleares fundamentais em um núcleo individual pudessem ser explicados. A instabilidade de um núcleo por decaimento em raios alfa foi explicada pelo físico russo George Gamow, em 1928, e por decaimento em raios gama pelo físico austríaco Victor Weisskopf, em 1951.
Apenas após a elaboração de uma teoria quântica que unificou os fenômenos eletromagnéticos e aqueles que envolviam o decaimento beta (denominada unificação eletrofraca), pelo paquistanês Abdus Salam e pelos americanos Sheldon Lee Glashow e Steve Weinberg, nos anos de 1970, pôde-se entender como o elétron, apesar de não existir no interior de um núcleo,o é criado no instante do processo de emissão. Com isso, o decaimento em raios beta foi compreendido e propriamente quantificado.
Assim, durante todo o século XX, o estudo da radioatividade apresentou problemas que exigiram a criação de teorias físicas que alicerçaram o triunfo da visão não determinística na descrição dos fenômenos naturais.
* NOTA: Todas as figuras foram elaboradas pelo próprio autor, à exceção da figura 2, adaptada de Caruso e Oguri, 2006.
LEITURAS RELACIONADAS:
FÍSICA MODERNA: origens clássicas e fundamentos quânticos, de Francisco Caruso e Vítor Oguri. Editora Elsevier, 2006.
The discovery of subatomic particles, de Steve Weinberg. Cambridge University Press, 2003.