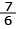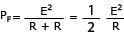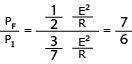Ano 8, n. 22, ano 2015

Em algumas raças de gado bovino, o cruzamento de indivíduos de pelagem totalmente vermelha com outros de pelagem totalmente branca produz sempre indivíduos malhados, com pelagem de manchas vermelhas e brancas.
Admita um grupo de indivíduos malhados, cruzados apenas entre si, que gerou uma prole de 20 indivíduos de coloração totalmente vermelha, 40 indivíduos com pelagem malhada e 20 indivíduos com coloração inteiramente branca.
O resultado desse cruzamento é exemplo do seguinte fenômeno genético:
(A) epistasia
(B) pleiotropia
(C) dominância
(D) codominância
Alternativa correta: (D)
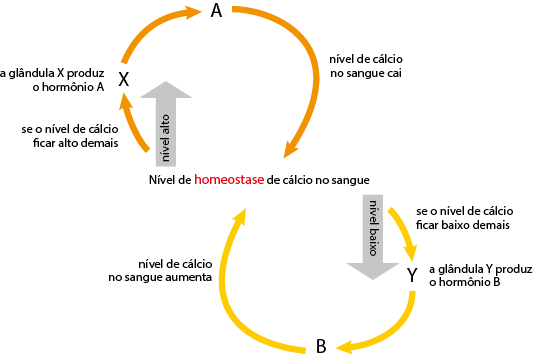
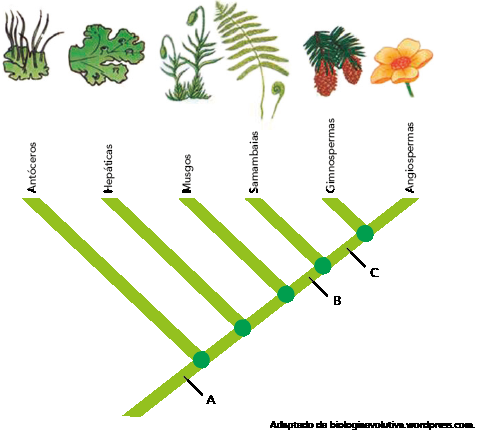
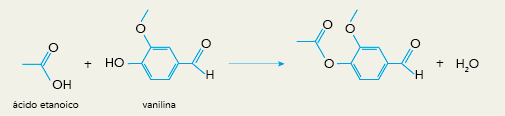
Eixo interdisciplinar: Os Seres Vivos e sua Relação com o Ambiente
Item do programa: As bases da genética
Subitem do programa: Hereditariedade e doenças hereditárias
Objetivo: Discriminar o tipo de herança genética de determinada prole.
Comentário da questão:
Os fenótipos da prole resultante desse cruzamento, para a característica analisada, obedecem à proporção 1:2:1, típica da herança por codominância. Nesse tipo de herança, os indivíduos heterozigotos não apresentam o mesmo fenótipo de qualquer um dos homozigotos, mas uma combinação das características dos dois fenótipos.
Percentual de acertos: 50,34%
Nível de dificuldade: Médio (acima de 30% e igual ou abaixo de 70%)